
Le noyau atomique est la minuscule région centrale de l’atome, dotée d’une charge électrique positive, où est concentrée la quasi-totalité de sa masse.
Bien qu’il ne représente qu’une fraction de la taille totale de l’atome, son influence est cruciale pour définir les propriétés chimiques et physiques des éléments.
Particules subatomiques du noyau
Le noyau est constitué de protons et de neutrons, appelés collectivement nucléons. Les protons ont une charge électrique positive, tandis que les neutrons sont électriquement neutres. Cependant, dans les noyaux d’hydrogène les plus simples (hydrogène-1), on ne trouve qu’un seul proton, dépourvu de neutrons.
Chaque élément chimique est défini par son numéro atomique (Z), qui correspond au nombre de protons présents dans le noyau et détermine sa charge électrique totale. De plus, le nombre de masse (A) est la somme des protons et des neutrons, fournissant une mesure approximative de la masse nucléaire.
Composition du noyau et sa structure
La quasi-totalité de la masse de l’atome se trouve dans le noyau, puisque les électrons, bien qu’essentiels aux interactions chimiques, ont une masse négligeable par rapport aux protons et aux neutrons. La taille du noyau varie selon l'élément : d'environ 1,75 femtomètres (fm) dans le noyau de l'hydrogène à 15 fm dans les éléments les plus lourds, comme l'uranium.
Les nombres fondamentaux qui décrivent le noyau atomique sont :
- Numéro atomique (Z) : nombre de protons.
- Nombre de neutrons (N) : nombre de neutrons dans le noyau.
- Nombre de masse (A) : somme des protons et des neutrons, A = Z + N.
Forces nucléaires et liaisons entre protons
La présence de protons chargés positivement génère une forte répulsion électrostatique au sein du noyau. Cependant, une force beaucoup plus puissante, connue sous le nom de force nucléaire forte, maintient les nucléons ensemble. Cette force est de courte portée mais suffisante pour contrecarrer la répulsion entre les protons.
L'énergie de liaison nucléaire, responsable de la cohésion du noyau, est libérée lors des réactions de fusion nucléaire. Dans ces processus, lorsque les liaisons nucléaires sont rompues, de l'énergie est générée selon l'équation d'Einstein :
E = mc 2
Cette relation décrit comment la perte de masse lors de ces réactions est convertie en énergie.
Exemples de noyaux atomiques dans l'énergie nucléaire
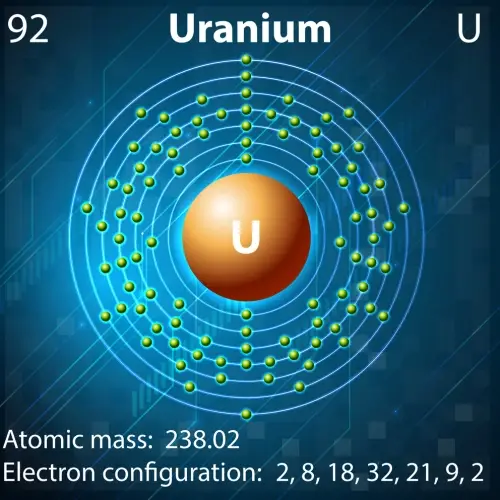 Dans le domaine de l’énergie nucléaire, certains noyaux atomiques sont indispensables en raison de leurs propriétés uniques :
Dans le domaine de l’énergie nucléaire, certains noyaux atomiques sont indispensables en raison de leurs propriétés uniques :
- Uranium-235 : Cet isotope de l'uranium est la clé des réacteurs nucléaires et des armes nucléaires. Son noyau, composé de 92 protons et 143 neutrons, est hautement fissile, ce qui signifie qu'il peut se diviser en noyaux plus petits lorsqu'il est bombardé de neutrons, libérant ainsi une énorme quantité d'énergie.
- Plutonium-239 : Produit artificiellement, c'est un autre noyau crucial pour la fission nucléaire. Il possède 94 protons et 145 neutrons et est utilisé à la fois dans les réacteurs et dans les armes nucléaires en raison de sa grande capacité à libérer de l'énergie.
- Deutérium (Hydrogène-2) : C'est un isotope de l'hydrogène utilisé dans les expériences de fusion nucléaire, où il se combine avec le tritium (Hydrogène-3) pour libérer de l'énergie propre. Cette réaction est à la base des recherches sur les réacteurs à fusion, comme ITER.
Modèles atomiques et évolution de la théorie de l'atome
La compréhension de la structure atomique a considérablement évolué au fil du temps. Les étapes les plus pertinentes sont mises en évidence ci-dessous :
- Modèle Dalton (1808) : John Dalton a proposé que toute matière soit constituée d'atomes indivisibles et invisibles. Ce modèle n'envisageait pas l'existence du noyau atomique.
- Modèle Thomson (1897) : Joseph John Thomson a découvert l'électron et a suggéré que les atomes avaient une structure interne. Il a postulé un modèle dans lequel les particules négatives (électrons) sont distribuées dans une masse positive, connu sous le nom de « modèle du pudding aux prunes ».
- Modèle Rutherford (1911) : Ernest Rutherford a découvert le noyau atomique grâce à la célèbre expérience de la feuille d'or. Il a déterminé que les atomes possèdent un petit noyau central dense entouré d’électrons.
- Modèle de Bohr (1913) : Niels Bohr a affiné le modèle de Rutherford, proposant que les électrons gravitent autour du noyau à des niveaux d'énergie définis. Ce modèle a introduit des concepts quantiques lors de la description des orbites électroniques.
Comparaison didactique pour comprendre les dimensions
 Pour comprendre les proportions du noyau par rapport au reste de l'atome, imaginez un gigantesque stade de football, comme le Camp Nou, complètement vide.
Pour comprendre les proportions du noyau par rapport au reste de l'atome, imaginez un gigantesque stade de football, comme le Camp Nou, complètement vide.
Au centre du stade, on place une petite bille. Cette minuscule sphère représente le noyau atomique, la partie centrale de l’atome où est concentrée la quasi-totalité de sa masse. Bien qu’elle soit incroyablement petite par rapport à la taille totale du stade, c’est la pièce la plus importante, car elle contient les protons et les neutrons qui déterminent les propriétés de l’atome.
Le reste du stade, tout cet immense espace vide, symbolise la région où se déplacent les électrons. Les électrons sont de minuscules particules chargées négativement qui tournent autour du noyau comme des abeilles planant autour d’une fleur. Bien qu’ils prennent beaucoup de place, ils pèsent si peu que leur masse contribue à peine à l’atome total.