
La théorie atomique de Dalton , proposée par le chimiste et physicien anglais John Dalton en 1808, a marqué un tournant dans le développement de la chimie moderne.
Bien que les idées sur l'existence de particules indivisibles qui composent la matière remontent aux philosophes grecs Leucippe et Démocrite , Dalton a été le premier à étayer ces idées par des preuves expérimentales, qui ont établi la théorie atomique comme un outil clé pour comprendre les réactions chimiques et leurs propriétés. de matière.
Postulats du modèle de Dalton
 La théorie atomique de Dalton repose sur une série de principes qui expliquent la nature et le comportement des atomes, les unités de base de la matière. Voici les quatre postulats principaux :
La théorie atomique de Dalton repose sur une série de principes qui expliquent la nature et le comportement des atomes, les unités de base de la matière. Voici les quatre postulats principaux :
- Les éléments sont constitués d'atomes indivisibles : Selon Dalton, les atomes sont des particules extrêmement petites, indivisibles et indestructibles qui constituent les éléments chimiques. Ce principe reflétait l’idée selon laquelle les atomes ne peuvent pas être décomposés en particules plus petites.
- Les atomes d'un même élément sont identiques : Tous les atomes d'un élément particulier ont les mêmes propriétés, notamment la masse et la taille. Cela implique que, par exemple, chaque atome d’oxygène est identique à tous les autres atomes d’oxygène.
- Les atomes de différents éléments peuvent se combiner pour former des composés : Les composés chimiques sont formés en combinant des atomes de deux éléments ou plus dans des proportions simples et définies. Ce principe a permis d'expliquer comment les éléments se combinent dans des proportions fixes pour créer de nouvelles substances.
- Les réactions chimiques impliquent le réarrangement des atomes : Dans une réaction chimique, les atomes sont réarrangés, mais ils ne sont ni créés ni détruits. Cela renforce le principe de conservation de la matière dans les réactions chimiques, concept déjà établi par Antoine Lavoisier.
Limites et erreurs
 Bien qu’elle constitue une avancée significative pour l’époque, la théorie atomique de Dalton n’était pas exempte d’erreurs et de limites. Avec le développement de la physique et de la chimie tout au long du XIXe et du début du XXe siècle, plusieurs aspects ont été découverts qui ne correspondaient pas au modèle original de Dalton :
Bien qu’elle constitue une avancée significative pour l’époque, la théorie atomique de Dalton n’était pas exempte d’erreurs et de limites. Avec le développement de la physique et de la chimie tout au long du XIXe et du début du XXe siècle, plusieurs aspects ont été découverts qui ne correspondaient pas au modèle original de Dalton :
- Les atomes ne sont pas indivisibles : L'une des principales erreurs de la théorie de Dalton est l'idée selon laquelle les atomes sont les particules de matière les plus petites et les plus indivisibles. À la fin du XIXe siècle, la découverte de particules subatomiques, telles que les électrons, les protons et les neutrons, a démontré que les atomes sont en réalité composés de particules encore plus petites.
- Existence d'isotopes : Dalton supposait que tous les atomes d'un même élément étaient identiques. Cependant, avec la découverte des isotopes au début du 20e siècle, il a été démontré que les atomes d'un élément peuvent avoir des masses différentes en raison de la présence d'un nombre différent de neutrons. Par exemple, les atomes d'hydrogène possèdent trois isotopes : le protium, le deutérium et le tritium, qui diffèrent par le nombre de neutrons.
- Les atomes peuvent se désintégrer dans certaines conditions : Dalton postulait que les atomes étaient indestructibles, mais les progrès de la physique nucléaire ont démontré que les atomes peuvent se désintégrer par des réactions nucléaires, telles que la fission et la fusion, ou par désintégration radioactive. Ces processus permettent aux atomes de libérer de l'énergie ou de se transformer en d'autres éléments.
- Tous les composés ne sont pas de simples combinaisons d'atomes : la théorie de Dalton suggérait que les composés étaient de simples combinaisons d'atomes de différents éléments. Cependant, l’émergence de composés plus complexes et la compréhension des structures moléculaires ont montré que les interactions entre atomes peuvent être beaucoup plus complexes que ne l’imaginait Dalton.
- Le modèle de Dalton n'explique pas les interactions électriques : Bien que Dalton ait reconnu que les atomes pouvaient se combiner pour former des composés, il n'a pas pu expliquer comment ces combinaisons se produisaient. Ce n'est qu'avec l'avènement du modèle atomique de Thomson et la découverte de l'électron que le rôle crucial des interactions électriques dans la formation des composés chimiques a commencé à être compris.
Les lois du poids de la chimie
La théorie atomique de Dalton a non seulement fourni une nouvelle perspective sur la nature de la matière, mais a également expliqué plusieurs lois physiques connues grâce aux lois du poids de la chimie que les scientifiques avaient déjà observées. Ces lois comprennent :
Loi de conservation de la masse
La loi de conservation de la masse, formulée par Antoine Lavoisier à la fin du XVIIIe siècle, stipule que la masse totale des substances participant à une réaction chimique reste constante. En d’autres termes, la quantité totale de matière avant et après une réaction chimique est la même.
La théorie atomique de Dalton a fourni une explication logique à cette loi, puisque selon son modèle, les atomes ne sont ni détruits ni créés lors de réactions chimiques, ils sont seulement réarrangés dans des configurations différentes.
Loi des proportions définies
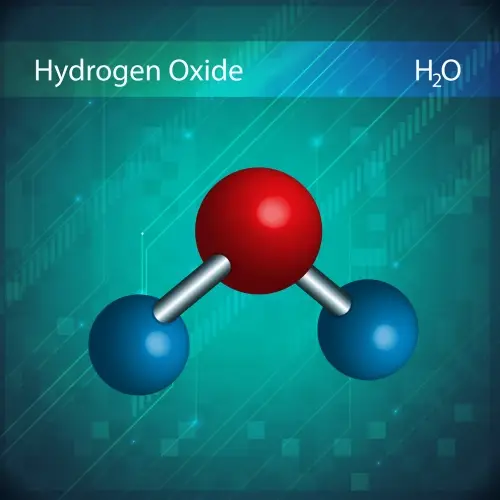 La loi des proportions définies, proposée par Joseph Proust en 1799, soutient qu'un composé chimique contient toujours les mêmes éléments dans la même proportion en masse.
La loi des proportions définies, proposée par Joseph Proust en 1799, soutient qu'un composé chimique contient toujours les mêmes éléments dans la même proportion en masse.
Par exemple, l'eau (H₂O) a toujours un rapport de 2 grammes d'hydrogène pour 16 grammes d'oxygène, quelle que soit la quantité d'eau analysée.
La théorie atomique de Dalton expliquait cette loi en suggérant que les composés sont constitués d'atomes de différents éléments combinés dans des proportions fixes.
Loi des proportions multiples
Une autre loi fondamentale que Dalton a expliquée avec sa théorie atomique est la loi des proportions multiples, qu'il a lui-même formulée. Cette loi stipule que si deux éléments se combinent pour former plus d’un composé, les quantités de l’un des éléments qui se combinent avec une quantité fixe de l’autre élément sont dans un rapport de nombres entiers simples.
Par exemple, le carbone et l’oxygène peuvent se combiner pour former à la fois du dioxyde de carbone (CO₂) et du monoxyde de carbone (CO). Dans le dioxyde de carbone, il y a deux atomes d’oxygène pour chaque atome de carbone, tandis que dans le monoxyde de carbone, il n’y en a qu’un.
Cela signifie que la quantité d’oxygène qui se combine à une quantité fixe de carbone est dans un rapport de 2 : 1, ce qui conforte l’idée selon laquelle les atomes se combinent dans des rapports simples et définis.
Impact sur le développement de la science
Malgré ses limites, la théorie atomique de Dalton a eu un profond impact sur la science, jetant les bases du développement de la chimie moderne. Son approche quantitative de la combinaison d'éléments a permis aux scientifiques de formuler des équations chimiques et d'étudier systématiquement les réactions. De plus, le modèle atomique de Dalton a joué un rôle déterminant dans le développement d'autres théories scientifiques clés, telles que la théorie des orbitales atomiques , la théorie quantique et le modèle standard de la physique des particules .
Le modèle de Dalton a également influencé le développement du tableau périodique des éléments, organisé par Dmitri Mendeleev en 1869, basé sur la relation entre les propriétés des éléments et leurs masses atomiques. Cette avancée a permis de classer des éléments de manière cohérente et de prédire les propriétés d'éléments qui n'avaient pas encore été découverts.
Evolution de la théorie atomique après Dalton
Au fil du temps, la théorie atomique de Dalton a été affinée et remplacée par des modèles plus précis.
L'une des avancées les plus significatives a été le modèle atomique de Thomson, également connu sous le nom de modèle « plum pudding », proposé en 1897. Dans ce modèle, l'atome était composé d'une masse positive dans laquelle étaient incorporés des électrons. Bien que ce modèle ait été remplacé par la suite, il s'agissait d'une étape cruciale vers le développement du modèle atomique de Rutherford, qui introduisait l'idée d'un noyau dense au centre de l'atome.
En 1911, Ernest Rutherford a réalisé sa célèbre expérience sur la feuille d’or, qui a démontré que la majeure partie de la masse de l’atome est concentrée dans un noyau central, avec des électrons en orbite autour de lui. Ce modèle a radicalement changé la vision de l’atome, suggérant qu’il n’était pas une masse solide, mais qu’il était principalement composé d’espace vide.
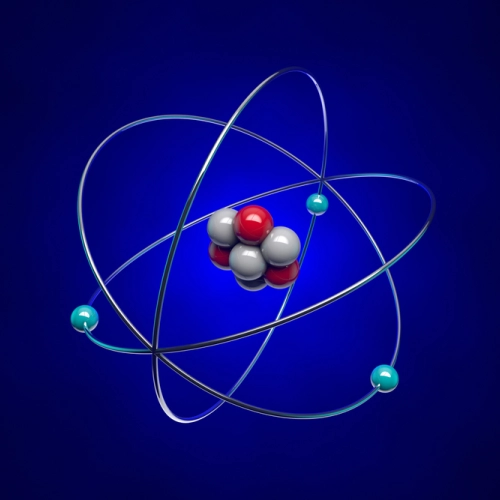 Plus tard, le modèle atomique de Niels Bohr, proposé en 1913, a amélioré le modèle de Rutherford en introduisant des niveaux d'énergie quantifiés pour les électrons. Selon Bohr, les électrons ne pourraient occuper que des orbites spécifiques autour du noyau et n'émettent ou n'absorbent de l'énergie que lorsqu'ils se déplacent entre ces niveaux.
Plus tard, le modèle atomique de Niels Bohr, proposé en 1913, a amélioré le modèle de Rutherford en introduisant des niveaux d'énergie quantifiés pour les électrons. Selon Bohr, les électrons ne pourraient occuper que des orbites spécifiques autour du noyau et n'émettent ou n'absorbent de l'énergie que lorsqu'ils se déplacent entre ces niveaux.
Même si le modèle de Bohr n'explique pas tous les phénomènes observés dans les atomes les plus complexes, il s'avère fondamental pour l'introduction de la mécanique quantique dans la description de la structure atomique.
Avec l'avènement de la mécanique quantique, le modèle de Schrödinger et l' équation des ondes de Schrödinger ont remplacé l'idée d'orbites fixes par des orbitales , qui sont des régions de l'espace où un électron est le plus susceptible de se trouver. Au lieu de considérer les électrons comme des particules en orbite autour du noyau selon des trajectoires définies, le modèle quantique décrit les électrons comme des ondes de probabilité.
Cette conception a été avancée par le principe d'incertitude de Heisenberg , qui stipule qu'il n'est pas possible de connaître avec précision simultanément la position et la vitesse d'un électron.
Conclusion
La théorie atomique de Dalton a marqué le début d'une nouvelle ère scientifique, fournissant une base solide pour l'étude de la matière et des réactions chimiques. Bien que son modèle se soit révélé simplifié et, à certains égards, incorrect, il a jeté les bases d’une compréhension plus approfondie de la structure atomique et des lois régissant les interactions entre les éléments.
Au fil du temps, la théorie atomique a évolué à mesure que de nouvelles découvertes étaient faites. Des modèles tels que ceux de Rutherford , Bohr et enfin la mécanique quantique de Schrödinger et Heisenberg ont élargi notre compréhension de l'atome, permettant aux scientifiques d'expliquer des phénomènes complexes que le modèle de Dalton ne pouvait pas aborder.
Aujourd’hui, les atomes restent le pilier fondamental de l’étude de la chimie et de la physique. Bien que les progrès technologiques nous aient permis d’approfondir la structure subatomique, la vision de Dalton reste pertinente dans de nombreux aspects de l’étude de la matière.
La capacité des atomes à se combiner dans des proportions définies pour former des composés reste un principe clé en chimie et sa théorie, bien que dépassée, est reconnue comme l’une des pierres angulaires du développement scientifique.
L'héritage scientifique de John Dalton est incontestable. Son insistance sur l’importance de l’observation empirique et son approche quantitative de la compréhension de la matière ont jeté les bases de la chimie moderne, et bien que des découvertes ultérieures aient révélé que sa vision de l’atome était incomplète, sa contribution reste une étape importante dans l’histoire de la science chimique.